研究
金沢大学循環器内科は、幅広い分野での研究経験が将来的に臨床の大切な礎になると考えています。臨床研究、基礎研究、そしてその間を埋める橋渡し研究 (トランスレーショナル・リサーチ) のいずれにも力を入れています。広く世界に向けても視野を広げ、個人の適性や興味に応じた研究ができるような研究指導を心がけています。
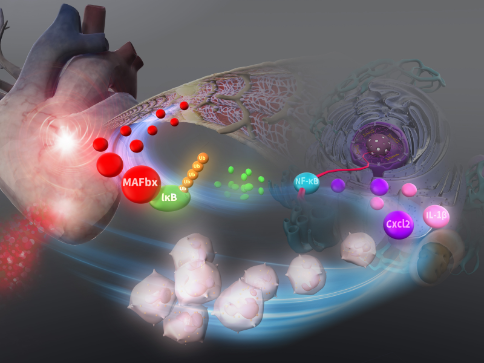
基礎研究を通して、心不全患者個々の病態に合わせた、より的確な個別化した心不全の予防・治療法を開発することを目的に研究を行っています。マウス大動脈縮窄モデルによる圧負荷や冠動脈結紮による心筋梗塞モデルをもちい、心臓リモデリング制御メカニズムを探究しています (図) 。また、心不全病態形成における臓器連関にも注目し、ヘパトカインを介した心臓―肝臓連関 (cardiohepatic interaction) の解明に尽力しています。
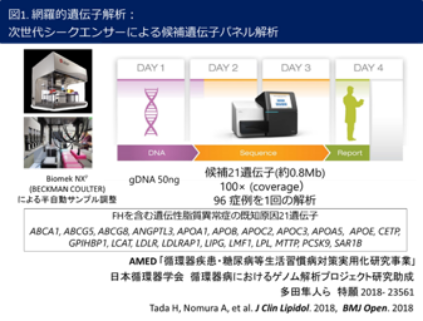
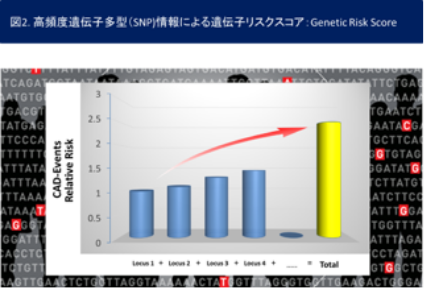
脂質異常症、不整脈、心筋症・心不全など循環器疾患の多くは遺伝し得る疾患です。従って私たちグループでは、遺伝的背景の解析により、診断のみならず、循環器疾患発症リスクの評価や重症度、さらにはその予後予測などいわゆる個別化医療の実践が可能であると考えています。このような信念の元、私たちグループでは約40年前から脂質異常症、不整脈、心筋症・心不全などの循環器疾患、特にメンデル型遺伝病である家族性高コレステロール血症、家族性心房細動、QT延長症候群、ブルガダ症候群、肥大型心筋症・拡張型心筋症などの遺伝子診断やその表現型の解析を行ってきました(文献1-4)。いわゆる次世代シークエンサーを用いた網羅的遺伝子解析を利用し、このようなメンデル型循環器遺伝病を迅速かつ確実に診断するスキームを独自に開発・運用し(図1. 平成28年度AMED循環器疾患・糖尿病等生活習慣病対策実用化研究事業、特願2018- 23561)、全国各地の医療機関・患者様からの遺伝子解析のご要望にお応えしてきた実績を誇ります(日本循環器学会 循環器病におけるゲノム解析プロジェクト研究助成)。今後は私たちが培ってきた希少疾患に関する遺伝子診断や重症度評価、予後予測などの個別化医療スキームを本邦の診療ガイドラインへと反映させるべく、そのスキームをさらにブラッシュアップするとともに、遺伝的背景に基づいた介入試験を行い、その臨床的有用性を明らかとしてゆく予定です(文献5)。また、希少疾患に留まらず高頻度遺伝子多型(いわゆるSNP)の重積による一般人口における循環器疾患罹患リスクの評価(図2. 遺伝子リスクスコア:Genetic Risk Score)に関する研究を世界に先駆けて遂行してきた実績を誇ります(文献6,7)。今後は本邦において、このような個別化医療の実践を目指して国内のゲノムデータベースも活用し、最終的には診療ガイドラインへの収載による一般化を目指します。
また、これまで米国ハーバード大学及びその関連機関と連携して疾患関連網羅的遺伝子解析により、新たな治療ターゲット分子探索研究を行い、難病であるホモ接合体性家族性高コレステロール血症に対する新たな治療ターゲット分子として注目されるANGPTL3分子の発見からその創薬に至るまで関与してきました(文献8)。引き続き国際・国内連携機関と協力し新たな治療ターゲット分子探索を継続します(文献9-13)。
- 1.Hayashi K, Konno T, Fujino N, Itoh H, Fujii Y, Imi-Hashida Y, Tada H, Tsuda T, Tanaka Y, Saito T, Ino H, Kawashiri MA, Ohta K, Horie M, Yamagishi M. Impact of Updated Diagnostic Criteria for Long QT Syndrome on Clinical Detection of Diseased Patients: Results From a Study of Patients Carrying Gene Mutations.
JACC Clin Electrophysiol. 2016 Jun;2(3):279-287 - 2.Tada H, Kawashiri MA, Nohara A, Inazu A, Mabuchi H, Yamagishi M. Impact of clinical signs and genetic diagnosis of familial hypercholesterolaemia on the prevalence of coronary artery disease in patients with severe hypercholesterolaemia.
Eur Heart J. 2017 May 21;38(20):1573-1579 - 3.Nomura A, Tada H, Kawashiri MA, Inazu A, Yamagishi M, Kathiresan S, et al.
Protein-Truncating Variants at the Cholesteryl Ester Transfer Protein Gene and Risk for Coronary Heart Disease.
Circ Res. 2017 Jun 23;121(1):81-88 - 4.Hodatsu A, Fujino N, Uyama Y, Tsukamoto O, Imai-Okazaki A, Yamazaki S, Seguchi O, Konno T, Hayashi K, Kawashiri MA, Asano Y, Kitakaze M, Takashima S, Yamagishi M. Impact of cardiac myosin light chain kinase gene mutation on development of dilated cardiomyopathy.
ESC Heart Fail. 2019 Apr;6(2):406-415 - 5.Nomura A, Tada H, Okada H, Nohara A, Ishikawa H, Yoshimura K, Kawashiri MA.
Impact of genetic testing on low-density lipoprotein cholesterol in patients with familial hypercholesterolemia (GenTLe-FH): a randomised waiting list controlled open-label study protocol.
BMJ Open. 2018 Dec 28;8(12):e023636 - 6.Tada H, Shiffman D, Smith JG, Sjögren M, Lubitz SA, Ellinor PT, Louie JZ, Catanese JJ, Engström G, Devlin JJ, Kathiresan S, Melander O. Twelve-single nucleotide polymorphism genetic risk score identifies individuals at increased risk for future atrial fibrillation and stroke.
Stroke. 2014 Oct;45(10):2856-2862 - 7.Tada H, Melander O, Louie JZ, Catanese JJ, Rowland CM, Devlin JJ, Kathiresan S, Shiffman D.
Risk prediction by genetic risk scores for coronary heart disease is independent of self-reported family history.
Eur Heart J. 2016 Feb 7;37(6):561-7 - 8.Stitziel NO, Nomura A, Kathiresan S; PROMIS and Myocardial Infarction Genetics Consortium Investigators, et al.
ANGPTL3 Deficiency and Protection Against Coronary Artery Disease
J Am Coll Cardiol. 2017 Apr 25;69(16):2054-2063 - 9.Liu DJ, Tada H, et al.
Exome-wide association study of plasma lipids in >300,000 individuals.
Nat Genet. 2017 Dec;49(12):1758-1766 - 10.Turcot V, Tada H, et al.
Protein-altering variants associated with body mass index implicate pathways that control energy intake and expenditure in obesity.
Nat Genet. 2018 Jan;50(1):26-41 - 11.Khera AV, Nomura A, Kathiresan S; Myocardial Infarction Genetics Consortium, DiscovEHR Study Group, CARDIoGRAM Exome Consortium, and Global Lipids Genetics Consortium, et al.
Association of Rare and Common Variation in the Lipoprotein Lipase Gene With Coronary Artery Disease.
JAMA. 2017 Mar 7;317(9):937-946 - 12.Emdin CA, Nomura A, Kathiresan S, et al. Analysis of predicted loss-of-function variants in UK Biobank identifies variants protective for disease. Nat Commun. 2018 Apr 24;9(1):1613
- 13.Emdin CA, Nomura A, Kathiresan S, et al.
Phenotypic Consequences of a Genetic Predisposition to Enhanced Nitric Oxide Signaling.
Circulation. 2018 Jan 16;137(3):222-232
「最先端医療技術トランスレーショナルリサーチグループ」
多様な医師の働き方が提唱される昨今において、”この医局に属する理由は何か”を各々が真剣に再考すべき時期に来ています。その中で、私たちはその理由のひとつが、“基礎的な実験で得られた最先端技術を開発し、自らの手で臨床試験を行ない、そしてその成果を新たな世代の標準治療とする、という一連の工程を一貫して行える”ことにあると考えます。これは、今の医療現場で起きている課題(ニーズ)の解決に際し、基礎研究を基盤とした最先端技術(シーズ)を開発し、それを臨床試験で検証し、一般臨床現場に届けるまでを一貫して行えるのは、医師[M.D.]だけでなく研究者精神をも培った医学博士[Ph.D.]を多数有する医局ならではの利点であり、また使命のひとつでもあろうかと思います。 本研究グループは、最先端技術の中でも特に、
- 1)ハイスループットシークエンサーを用いた遺伝子検査・遺伝学的検査
- 2)人工知能(機械学習、深層学習)による循環器疾患発症予測
- 3)モノのインターネット(IoT)技術を応用した新たな検査・治療用医療機器
による基礎研究、臨床試験を行っております。これは、遺伝子検査、遺伝学的検査の臨床的有用性を検証するだけなく、機械学習や深層学習を組み合わせることで、循環器予防医学分野においてもより精度の高い循環器疾患発症前予測ならびにリスク層別化を目指しています。これにより、循環器疾患発症の高リスクの患者さんを予め見つけ出し、その方々に適切な医療介入を行うことでその疾患の発症を未然に防ぐ、すなわちプレシジョン医療の推進を目指します。
高血圧や糖尿病などの生活習慣病の遠隔期においては、虚血性心疾患や心不全の発症が予後に強くかかわることが知られています。心不全においては、慢性期の交感神経活動の亢進と予後との関連が示されており、いかに安定化させながら心不全治療をするかが重要になってきます。心不全における交感神経活動の抑制目的にベーターブロッカーを使用することが推奨されています。しかし、日常臨床における心不全においては、単に心不全だけでなく、糖尿病、高血圧、心房細動を代表とする不整脈など併存疾患が多く、それぞれに対して交感神経活動を安定化させながら最適の薬剤を選択する必要があります。我々の研究室は、ヒトにおける交感神経活動測定法である筋交感神経活動(MSNA)が測定できる世界でも限られた施設の一つです。これまでに、併存疾患と心不全の交感神経活動を介した悪循環および薬剤の影響を探求してきました(図1)。また、我々の研究の一部は、AHA/ACCのガイドラインにも引用されました(2014 AHA/ACC/HRS Atrial Fibrillation Guideline)。今後、交感神経活動に対するデバイス治療や新薬の交感神経活動に対する功罪など、臨床的に重要なプロジェクトを行っていく予定です。研究で明らかとなった知見を臨床にフィードバックすることを常に考えながら一つ一つのプロジェクトを達成できるよう日々取り組んでいます。
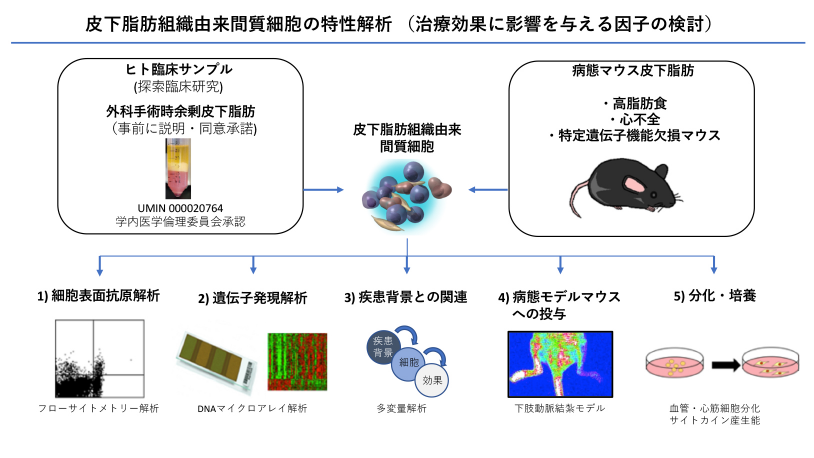
「脂肪組織由来幹細胞による心筋再生、血管新生治療実用化基礎研究」
1. 脂肪組織由来幹細胞の治療効果に影響を与える因子についての研究
我々のグループでは、この皮下脂肪由来間質細胞群を用いた再生治療の臨床試験(対象:虚血性心不全、重症虚血肢)(心血管再生医療の項参照)を行う中で、患者さん毎に治療効果に個人差があることを見出しました。間質細胞群は、多種類の細胞の集合体であり、患者さんごとにプロファイル(顔つき)が異なることから、「どのような特性が、高い治療効果に関係」するのかを明らかにするための基礎研究を行っています。これまでの研究で、高い血管新生能に関与する幹細胞サブクラスとその脂肪組織内含有率に影響する全身疾患背景を明らかにしました(論文投稿中)。
2. 脂肪組織由来幹細胞の自律拍動心筋細胞への分化
虚血性心不全(特に急性心筋梗塞再灌流後)に対する細胞治療の治療効果メカニズムに関しては、細胞の直接心筋分化は極めて限定的で、パラクライン作用による抗炎症効果、抗アポトーシス効果が主体とされてきました。これまで心臓再生医学の分野では、体性幹細胞を「自律拍動する心筋細胞集塊」へ分化させることは困難と考えられてきました。最近、私たちのグループでは、脂肪組織幹細胞の一部が、分化誘導を行わずに、自律拍動特性を有する心筋様細胞集塊に再現性をもって分化する条件を見出しました。これを契機に、脂肪組織由来幹細胞の心筋細胞への分化メカニズムの解明と分化効率向上を目指した研究を行っています。
遺伝情報を考慮した不整脈診療と機能解析による疾患発症機序の解明
1. 遺伝情報を考慮した不整脈診療
単一遺伝子病は一つの遺伝子の病的バリアント(DNA配列の変化)によって発症する病気で、不整脈疾患では先天性QT延長症候群(LQTS)などが挙げられます。LQTSとは心電図でQT延長を認め、多形性心室頻拍(torsads de pointes, TdP)や心室細動(VF)の発生により失神や突然死を引き起こす症候群で、β遮断薬が発作予防に有効です。先天性LQTSのほとんどが常染色体顕性遺伝形式であり、その有病率は無症候性を含めると2000人に1人です。LQTSの原因は心筋の興奮と回復に関わる心筋イオンチャネル遺伝子の病的バリアントで、臨床的にLQTSと診断された症例の75%に病的バリアントが認められ、同定された変異の90%を占める遺伝子がKCNQ1(LQT1, 30-35%)、KCNH2(LQT2, 25-30%)、SCN5A(LQT3, 5-10%)です。これまで3遺伝子型と臨床所見(表現型)との関連の詳細な検討が行われ,遺伝子型別,遺伝子変異別の臨床所見、β遮断薬の有効性が報告されています(表)。遺伝子解析は、循環器科医が臨床経過,家族歴,心電図で強く先天性LQTSを疑う症例、あるいは一連の12誘導心電図でQTc>480 msec(未成年)または>500 msec(成人)を呈する無症状のQT延長症例に対して行います。当科では遺伝子解析によって得られる遺伝情報を考慮し、診断、生活指導および治療を行っています。また、当科ではLQTSの他、家族歴があり、若年発症の遺伝性不整脈疾患(Brugada症候群、カテコラミン誘発多形性心室頻拍、不整脈原性右室心筋症、家族性徐脈、家族性心房細動など)に対して積極的に遺伝子解析を行っています。該当する症例をお持ちで遺伝子解析を考慮されている方はぜひ当科までご相談ください。
2. 機能解析による疾患発症機序の解明
近年の遺伝子解析技術の発展により、当科でも次世代シークエンサーによる遺伝子解析に移行しつつあり、一度に数多くの遺伝子変異の有無を網羅的に解析することが可能です。網羅的遺伝子解析を行うことにより、病的バリアントだけでなく、病的意義がわからないバリアントも同定されます。当科では遺伝子解析によって見いだされたバリアントに対して、家族解析および機能解析を行ってその病的意義を明らかにし、疾患の発症機序を明らかにしています。機能解析の方法としてパッチクランプ法を用いた細胞電気生理学的検討、コンピューターシミュレーションによる活動電位および不整脈発症の予測、ゼブラフィッシュ胚を用いた変異遺伝子の機能評価などを行っています。
表 LQT1, LQT2, LQT3の臨床像の比較
| LQT1 | LQT2 | LQT3 | |
| 原因遺伝子 | KCNQ1 | KCNH2 | SCN5A |
| 頻度 | 30~35% | 25~30% | 5~10% |
| 好発年齢・性別 | 10 歳代までの男児 | 思春期以降の女性 | ー |
| QT延長の誘因 | 運動,水泳, ランニング,驚愕, 怒り,興奮 |
音刺激,安静, 徐脈, 産後 |
安静, 睡眠時 |
| T波形態 | 幅広いT波 | 平低ノッチ型 | 遅発性T波 |
| Β遮断薬の効果 | 著効 | 有効 | 有効(女性) |
